富士フイルムグループの富士ゼロックス株式会社は、業務遂行の証跡や商取引等で発生する証憑類を確実かつ堅ろうに記録管理するソフトウェア「Apeos PEMaster Evidence Manager 2.3」の機能を強化し、管理する記録の真正性を確保する機能を追加いたしました。11月7日から、アドバイザリーサービスも含め、薬事法規制要件対応の文書管理ソリューションを本格展開します。
■薬事法規制に対応する企業の現状
「薬事法」は、医薬品・医薬部外品・化粧品・医療機器の有効性・安全性・品質の確保のために必要な規制などを定めた法律です。製薬、医療機器、化粧品業界等のお客様は、厚生労働省の定める「医薬品および医薬部外品の製造管理および品質管理の基準に関する省令」(GMP省令)や、「医薬品、医薬部外品、化粧品および医療機器の品質管理の基準に関する省令」(GQP省令)など、「GxP※注1」とよばれる各種規制に対応し、設計・製造、品質管理、検査結果の管理などのプロセスで法規制の対象となる文書を保存義務に従って確実に管理し、審査機関等の調査に適切に対応することが求められています。
近年は業務の複雑化により、管理すべき記録の種類や量も増えているため、これらの保管や検索の負荷軽減が大きな課題となり、電子で効率的に管理したいと考える企業が増えています。しかし、作業上、指定様式の紙へ手書きする記録も多く、電子で管理するには電子データの信頼性を確保するための要件を定めた厚生労働省医薬食品局発行のガイドライン(ER/ES指針)への対応が求められ、なかなかシステム化が進められないという現状があります。
■富士ゼロックスが提供する薬事法規制対応文書管理ソリューション
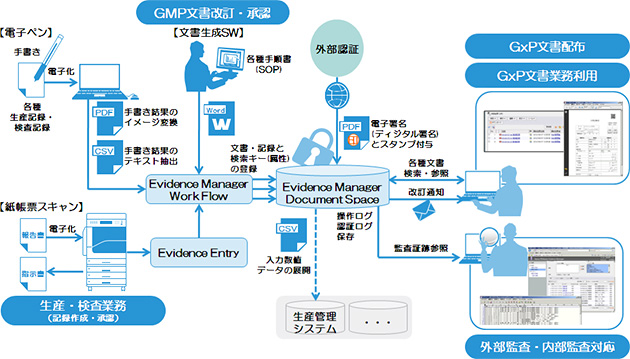
同社は、薬事法規制の対象となる製薬、医療機器、化粧品業界のお客様向けに、「Apeos PEMaster Evidence Manager 2.3」が従来から提供する記録管理やワークフロー機能に加え、記録の真正性を確保する機能を下記の通り追加し、強化しました。
※注1
1.ワークフロー上の承認者の本人確認と電子署名付与により承認行為の正当性確認を強化
2.操作ミスなどを含むトラブル時の早期原因究明のため監査証跡の閲覧性を強化
これにより、「ER/ES指針」および米国食品医薬品局制定の「FDA 21CFR Part11※注2」に対応する文書管理システムを構築できます。システム構築のみでなく、お客様のご要望に応じてアドバイザリーサービスも提供します。CSV※注3、運用・維持の見直しまでトータルに支援することで記録管理を正確かつ効率的に行える仕組みを作り、規制要件を満たすことはもちろん、お客様の業務プロセス最適化に貢献するソリューションを提供します。
さらにApeos PEMasterシリーズ、複合機、電子ペンなどを合わせてご利用いただくことで、紙と電子の統合管理によるペーパーレス化を促進し、記録の登録作業から管理までの一連の作業をスムーズに行える環境作りも支援します。
同社は今後も、強みであるドキュメントの管理、活用に関するノウハウを活かし、さまざまな規制要件への対応と業務効率化を両立するソリューションを提供してまいります。
規制要件対応とバリデーションを考慮したうえで、文書および記録の制作/保存効率とその有用性を高めるシステム環境を構築します。
※注1
GxP
Good x practice(適正 x 基準、優良 x 規範)の略で、安全性や信頼性を確保することを目的に政府等の公的機関で制定する基準を表す。
※注2
FDA 21CFR Part11
米国食品医薬品局(Food and Drug Administration)が、製薬会社に対して、米国で医薬品の販売許可を申請する際に提出することを義務づけている電子記録・文書について遵守すべき要件を定めたもの。
※注3
CSV(コンピューター化システムバリデーション)
コンピューター化システムの正当性を保証するため開発から運用までシステム全般の活動を文書化して記録、保管すること。厚生労働省発行の「医薬品・医薬部外品製造販売業者等におけるコンピューター化システムバリデーション適正管理ガイドライン」に対応することが求められる。
※リリースの詳細は関連資料をご参照ください
【関連資料】
◎リリースURL/PDF
http://news.fujixerox.co.jp/news/2012/000805/
◎富士ゼロックス株式会社:公式サイト
http://www.fujixerox.co.jp/