松岡史也 農学研究科 修士課程学生、河井重幸 同助教、橋本 渉 同教授、村田幸作 摂南大学理工学部教授(京都大学名誉教授)らの研究グループは、海洋バイオマス資源(大群落を形成するコンブなどの大型褐藻)に多く含まれるアルギン酸モノマーとマンニトール(褐藻に特有な単糖)を利用できるように代謝改変した出芽酵母が、どのようにしてアルギン酸モノマーの代謝能を向上させるのか、その分子メカニズムの一端を明らかにしました。
同知見は、将来、日本の広大な管轄海域で栽培可能な国産海洋バイオマス資源を原料として、代替ガソリンや合成ゴム原料などのシェールガスからは生産し難い有用化合物を酵母発酵により生産する場合に極めて有用な知見となります。これにより石油資源への依存度が下がると共に、水産業の振興、更には管轄海域の保全にも寄与できると期待されます。本研究成果は 2017 年 6 月 23 日午後 6 時(日本時間)、英国の学術誌 Scientific Reports に掲載されました。
1.背景
出芽酵母(パン酵母)は強力な発酵能を示し、その名の通りパンやお酒つくりに欠かせない安全な食品微生物です。石油資源への依存度を減らすために、米国やブラジルではトウモロコシやサトウキビからの大規模バイオエタノールの生産に出芽酵母が利用されています。残念ながら、我が国では米国やブラジルほどにはトウモロコシもサトウキビも生産できません。しかし、海に囲まれ広大な管轄海域に恵まれている我が国では、潜在的には大量の国産海洋バイオマス(大型褐藻)の生産が可能です。そこで、藻場という大群落を形成するコンブなどの大型褐藻を発酵させることで有用化合物を生産するという着想が生まれますが、酵母は褐藻の主成分アルギン酸とマンニトールを利用できないという問題がありました。
2.研究手法・成果
このような状況の中、当分野では 2012 年より強制的に出芽酵母がアルギン酸とマンニトールを利用できるようにする研究を開始しました。高分子アルギン酸のモノマー体の代謝に必要な 4 つの遺伝子(アルギン酸モノマー取り込み遺伝子 DHT1 と図1に示す A1-R’、Eda、KdgK の各遺伝子)とマンニトール代謝に必要な 2つの遺伝子(DSF1 と HXT17)を 2 種類の出芽酵母のゲノム DNA に組み込んだだけではアルギン酸モノマーの代謝能は不十分でしたが、適応進化(アルギン酸モノマーを含む培地で~160 世代、~30 回の継代培養をする)により両酵母のアルギン酸モノマー代謝能の向上に成功しました。すなわちアルギン酸モノマーとマンニトールを利用できる酵母の作出に成功しました。しかし、代謝能が向上するメカニズムは不明でした。もしこのメカニズムが明らかになれば、アルギン酸モノマーとマンニトールを利用できる代謝改変出芽酵母を構築する上で極めて有用な情報となります
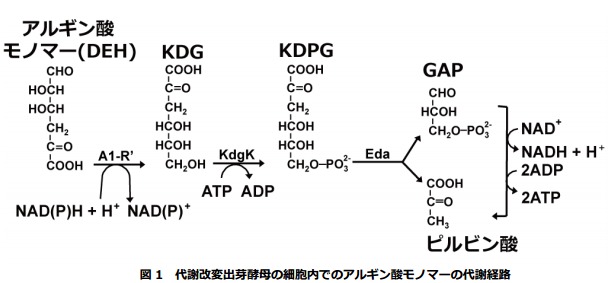
図の A1-R’、KdgK、Eda の各遺伝子およびアルギン酸モノマー輸送体遺伝子のコドンを出芽酵母型に最適化した上で、プロモーターとターミネーター配列に挟み込んで、出芽酵母ゲノム DNA の特定の領域に挿入した。
そこで、アルギン酸モノマー代謝能向上のメカニズムを明らかにすべく研究を進め、そのメカニズムの一端を明らかにしました(図 2)。すなわち、導入した遺伝子の一つアルギン酸モノマー(DEH)還元酵素(A1-R’:図 1)遺伝子(a1-R’)の 50 番目の A が G に変異することで同酵素にアミノ酸置換(E17G置換:17 番目のグルタミン酸残基がグリシン残基に置換)が引き起こされた結果、その活性が向上し、アルギン酸モノマー代謝能が向上したことを明らかにしました(図 2)。
驚くべきことに、2 種類の異なる出芽酵母を用いて適応進化を行いましたが、両方の出芽酵母の同じ遺伝子の同じ箇所に代謝能を高める変異が導入されていました(図 2:左)。変異箇所は、補酵素 NAD(P)H との結合箇所の近傍に位置していました(図 2:右)。なお、図 2 に示すスフィンゴモナス属細菌 A1 株由来の本還元酵素 A1-R’の立体構造も当分野で決定されたものです(JBC 2014)。KdgK および Eda 両酵素遺伝子(図 1)は出芽酵母には見られませんが、アルギン酸モノマーを代謝できない大腸菌等多くの微生物にも比較的広範囲に存在します。
一方、アルギン酸モノマー還元酵素(A1-R’:図 1)は補酵素(還元力)NAD(P)H を用いてアルギン酸モノマーを還元する反応を触媒しますが、本酵素はアルギン酸モノマーを代謝できる微生物にのみ見られるアルギン酸モノマー代謝の鍵酵素です。本成果は逆に言うと、NAD(P)H の利用を伴うアルギン酸モノマーの還元反応がアルギン酸モノマーの代謝にとって決定的に重要であることを証明したことになりました。
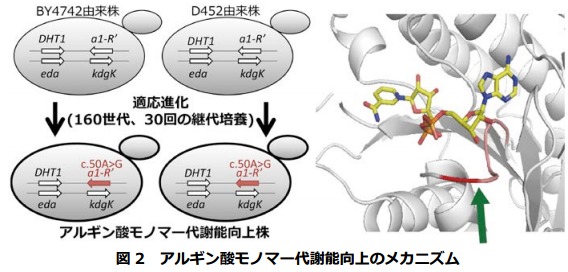
2種類の代謝改変酵母の適応進化(~160 世代、~30 回の継代培養)の結果、ともにアルギン酸モノマー還元酵素遺伝子(a1-R?)の同じ箇所に変異が入った(左図)。その結果、同還元酵素(A1-R?)の NAD(P)H 結合部位近傍の矢印箇所(右図)のグルタミン酸残基がグリシン残基に置換され、同酵素活性が上昇し、代謝改変酵母株のアルギン酸モノマーの代謝能が向上した。アルギン酸モノマーを資化できる代謝改変酵母を新たに構築する際、もう煩雑な適応進化をしなくても済む。
3.波及効果、今後の予定
今後は、今回得られた知見を基に、代替ガソリン(イソブタノール)や合成ゴム原料(2,3-ブタンジオール)合成系も組み込むことにより、酵母発酵による国産海洋バイオマス資源からの代替ガソリンや合成ゴム原料等の有用化合物生産の実用化を目指します。これにより石油資源への依存度を下げると共に、水産業の新興、更には管轄海域の保全にも寄与できると期待されます。一方、出芽酵母が本来は利用できないアルギン酸モノマーやマンニトールを利用できるようになったわけですが、このとき酵母細胞内で何が起こっているのか?といった疑問にも補酵素 NAD(P)H 合成制御にも目配せしつつ答えていきたいと思います。
4.研究プロジェクトについて
本研究は、第 11 回 農芸化学研究企画賞、JST A-STEP FS ステージ、公益財団法人 岩谷直治記念財団、公益財団法人 アサヒグループ学術振興財団、公益財団法人 松籟科学技術振興財団による支援を受けました。
<論文タイトルと著者>
タイトル:
Crucial role of 4-deoxy-L-erythro-5-hexoseulose uronate reductase for alginate utilization revealed by adaptive evolution in engineered Saccharomyces cerevisiae
著者:
Fumiya Matsuoka, Makoto Hirayama, Takayuki Kashihara, Hideki Tanaka,Wataru Hashimoto, Kousaku Murata, Shigeyuki Kawai
掲載誌:
Scientific Reports
【詳細は下記URLをご参照下さい】
・京都大学、摂南大学 2017年6月26日発表【PDF】
・京都大学 公式サイト
・摂南大学 公式サイト
・[特集]機能性表示食品制度[機能性表示対応素材]《更新随時》